환자 안전 우려에 의료계 “근본적 품질관리 대책 필요”…지역 유통망 혼선도 지적
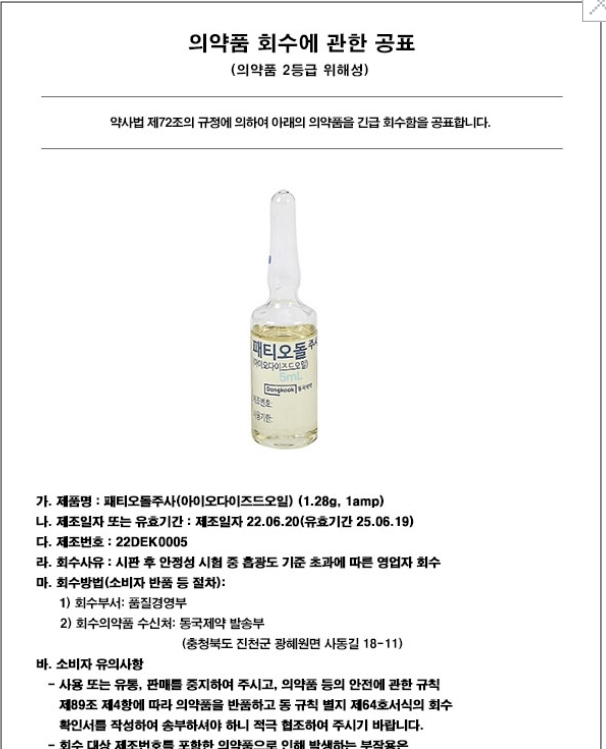
동국제약(주)이 자사 주사제 ‘패티오돌주사(아이오다이즈드오일)’의 자발적 회수에 나섰다.
해당 제품은 최근 시판 후 안정성 시험 과정에서 출광도 기준을 초과해 품질 부적합 판정을 받았으며, 현재 전국 의료기관 및 약국에 판매 중지 및 반품 회수 조치가 내려진 상태다.
회수 대상은 제조번호 22DEK0005, 제조일자 2022년 6월 20일, 유효기간 2025년 6월 19일인 제품으로, 1.28g(1앰플) 단위 포장이다.
동국제약은 지난 3월 1일 식품의약품안전처에 해당 사실을 신고하고, 법령에 따라 회수 절차를 밟고 있다고 밝혔다.
회사 측은 “환자 안전을 최우선으로 고려해 자진 회수를 결정했으며, 재발 방지를 위한 품질관리 체계 개선을 추진 중”이라고 전했다.
의료계 “환자 안정성 확보 위한 재발 방지 대책 시급”
이번 회수에 대해 의료 현장에서는 신속한 조치 자체는 환영하면서도, 반복되는 품질 이슈에 대한 근본적인 해결책이 필요하다는 지적이 잇따르고 있다.
청주의 한 종합병원 영상의학과 전문의는 “조영제 계열 제품은 영상 진단의 핵심 도구인 만큼 품질에 민감하다”며
“출광도는 영상 신호의 정확성에 영향을 미칠 수 있는 지표이기 때문에 이번 회수는 환자 보호 차원에서 반드시 필요한 조치였다”고 말했다.
지역 유통망 “현장 전달 느려…일부 병의원은 아직 인지 못해”
회수 공지가 다소 늦게 전달되며 일부 유통 현장에서 혼선도 발생하고 있다. 제천지역의 한 의약품 도매상은 “제품이 광범위하게 유통된 만큼, 소규모 병·의원에서는 공지를 못 받은 곳도 있다”며
“회수 대상 여부를 의료진이 인지하지 못한 채 사용될 가능성도 배제할 수 없다”고 우려했다.
전문가 “출광도 기준 초과는 공정 이상 가능성…제조 환경 점검 필수”
의약품 품질안전 전문가인 한국의약품감시학회 정재훈 회장은 “출광도 기준 초과는 제조 공정 또는 원료 상태 이상과 밀접한 관련이 있다”며
“사후 회수보다는 유통 전 검증체계(PMS) 강화가 장기적으로 비용과 위험을 줄이는 방향”이라고 지적했다.
또한 그는 “유사 품목에서 반복되는 사례가 다수 존재하므로 식약처는 제조사의 품질 시스템 전반에 대한 실태조사를 병행해야 한다”고 덧붙였다.
현재 회수 절차 진행 중…의료기관 대상 협조 요청
동국제약은 전국 의료기관, 약국에 제품 분리 보관 후 반품 요청 공문을 발송했으며, 반품은 충북 진천군 광혜원면 본사 반송부에서 접수 중이다. 회수 관련 문의는 동국제약 품질경영부(043-530-0275)를 통해 가능하다.
해당 의약품 사용 중 부작용이나 이상 사례가 있을 경우에는 한국의약품안전관리원 또는 식약처에 즉시 신고해야 한다고 회사 측은 강조했다.